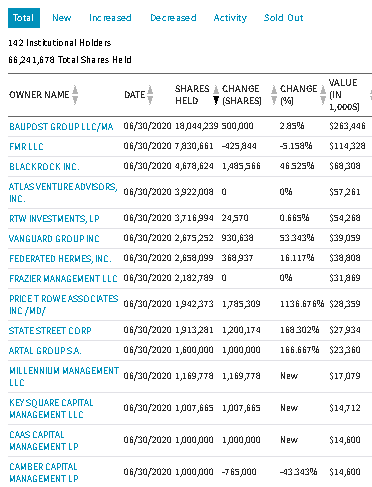
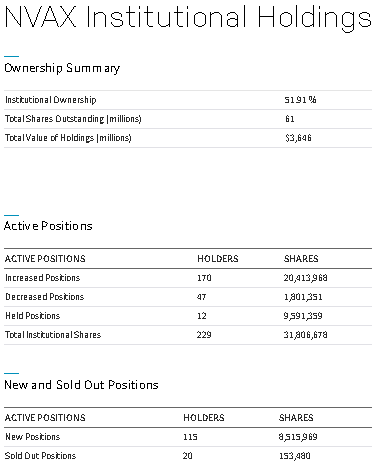
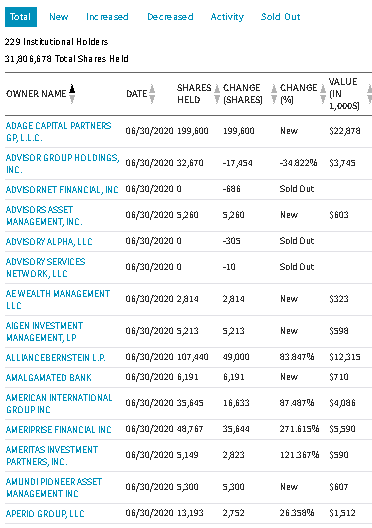
新型コロナウイルスの状況に影響を受けるバイオ・ヘルス株を統計的に分析します。この記事は「Python3ではじめるシステムトレード:新型コロナで見ておくべきバイオ・ヘルス株(長期投資・短期投資)」を2分割した後半です。
最初に準備をします。
Python3を用いてデータをダウンロードするためには、jupyter notebookとpandas-datareaderがお勧めです。jupyter notebookのインストールについてはPython3ではじめるシステムトレード:Jupyter notebookのインストールを参考にしてください。ここにpandas-datareaderのインストールの説明もあります。また、Yahoo Finance USから株価をダウンロードしてみたを参考にしてください。
import matplotlib.pyplot as plt #描画ライブラリ
import pandas_datareader.data as web #データのダウンロードライブラリ
import numpy as np
import pandas as pd
from statsmodels.tsa.stattools import adfuller
#import datetime
#a=datetime.datetime.now()
def ShorttermInvest(PORT,start='2010/1/4'):
i=1
for asset in PORT:
tsd = web.DataReader(asset,"yahoo",start).dropna()#jpy
ts=tsd.loc[:,'Adj Close']/tsd.iloc[0,5]
ts.plot(label=str(asset))
print(asset,adfuller((ts),regression='nc')[1:3],
adfuller((ts),regression='c')[1:3],
adfuller((ts),regression='ct')[1:3],
adfuller((ts),regression='ctt')[1:3])
if i==5:
plt.legend()
plt.show()
i=0
i+=1
if i!=1:
plt.legend()
plt.show()
短期の株価に影響を与える要素
- 治験の状況
- 企業の戦略の見直し・ファイナンス戦略の見直し
- 個人投資家の動き
- 大口投資家の動き
- 資金獲得状況
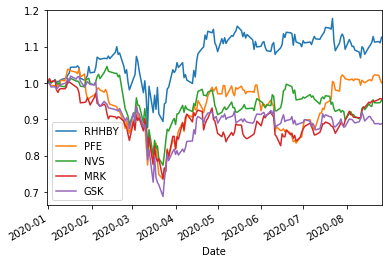
2020年のバイオ・ヘルス株の動き
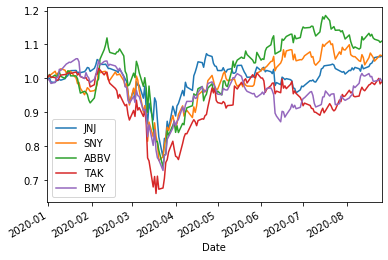
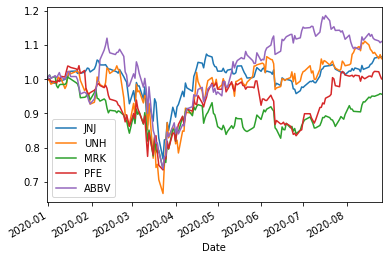
TOP10=['RHHBY','PFE','NVS','MRK','GSK','JNJ','SNY','ABBV','TAK','BMY']
ShorttermInvest(TOP10,'2020/1/1')
RHHBY (0.811946137799602, 1) (0.30942615547228847, 1) (0.3220211353356668, 1) (0.5513302939730502, 1) 0.38504449524716516
PFE (0.6482962672774243, 1) (0.0645235864945026, 9) (0.18523311862999264, 9) (0.315496634828133, 9) 0.38749058745254766
NVS (0.5583686447100411, 2) (0.13467610165025196, 2) (0.3948103870388639, 2) (0.5477761778775136, 2) 0.3323036881273197
MRK (0.5458635448612557, 10) (0.09112990447475411, 9) (0.46179040107344754, 9) (0.17206740197627196, 9) 0.3690012852398665
GSK (0.47706122743974, 5) (0.1552393270171073, 5) (0.4400899847696595, 5) (0.6094296089633989, 5) 0.35687046969435654
JNJ (0.7230430143415582, 9) (0.0585597119457908, 9) (0.12446790876009373, 9) (0.18341091948189497, 9) 0.3476385736968938
SNY (0.7372288841678856, 1) (0.44100189948214197, 9) (0.28646450813637997, 9) (0.6290915980291729, 9) 0.3486747201111218
ABBV (0.7488047929209422, 10) (0.623518646151443, 10) (0.46154321783211455, 12) (0.771831872434569, 12) 0.38799452370269444
TAK (0.6014160162220097, 2) (0.2875461854202449, 2) (0.5907161293412132, 2) (0.7673412591729605, 2) 0.39252048263673905
BMY (0.5708121325471311, 8) (0.10459407736004045, 9) (0.3737151446268847, 9) (0.48779877373237324, 9) 0.3192459990166295
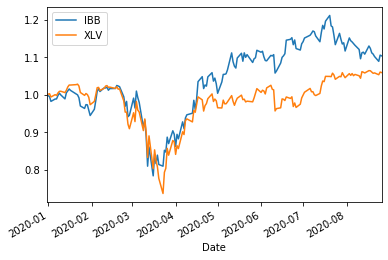
ETF=['IBB','XLV']
ShorttermInvest(ETF,'2020/1/1')
IBB (0.7604269961042831, 9) (0.6082888918537089, 9) (0.4499755975016993, 9) (0.8476348956304955, 9) 0.37040065471027805
XLV (0.6994999567699338, 9) (0.30122203072939424, 9) (0.33249366687090964, 9) (0.41530904399984164, 9) 0.35462749108997343
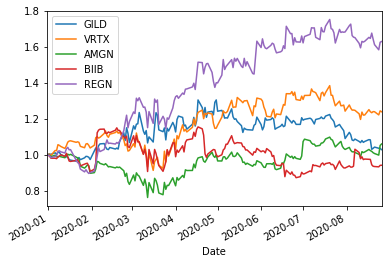
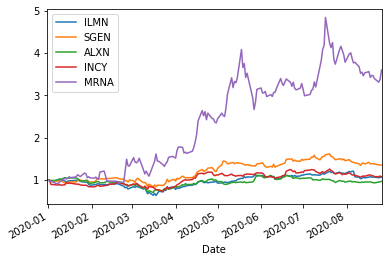
BIO10=['GILD','VRTX','AMGN','BIIB','REGN','ILMN','SGEN','ALXN','INCY','MRNA']
ShorttermInvest(BIO10,'2020/1/1')
GILD (0.6972541495512711, 9) (0.4177614091578511, 9) (0.9745090193175501, 9) (0.1374063406911818, 11) 0.4400210072952052
VRTX (0.8103496039391536, 9) (0.5197847698900361, 9) (0.499506472750137, 9) (0.6557051579542991, 9) 0.46371723576491686
AMGN (0.7305564050993771, 9) (0.5167672519475187, 9) (0.03294613413303493, 12) (0.09910015229408436, 12) 0.42594458265397095
BIIB (0.5581600706916606, 9) (0.10900228870225298, 9) (0.08224661044693177, 9) (0.14484111447758236, 9) 0.5120038083080366
REGN (0.9693732136773923, 9) (0.6566488623784288, 9) (0.5688215332700192, 1) (0.03327520624529434, 2) 0.4670359365850366
ILMN (0.7517908551686406, 9) (0.7250505978397338, 9) (0.5826423495981745, 9) (0.9856215720905096, 8) 0.4863181357830774
SGEN (0.8419178630353537, 0) (0.7051712712844975, 0) (0.7047150274938639, 0) (0.8437344770104152, 0) 0.4745238999883913
ALXN (0.5842338870493966, 0) (0.26093894779095844, 9) (0.3494128676154856, 9) (0.7613976399730276, 9) 0.41793815214024377
INCY (0.6968943206342108, 0) (0.6557596245502446, 0) (0.5091729400102473, 0) (0.5459427871628262, 0) 0.4414327599585027
MRNA (0.853909585603465, 0) (0.7239651148438297, 0) (0.22983501259511996, 0) (0.367587604473926, 0) 1.0584691410981335
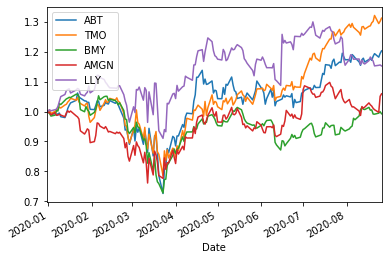
HLT10=['JNJ','UNH','MRK','PFE','ABBV','ABT','TMO','BMY','AMGN','LLY']
ShorttermInvest(HLT10,'2020/1/1')
JNJ (0.7230430143415582, 9) (0.0585597119457908, 9) (0.12446790876009373, 9) (0.18341091948189497, 9) 0.3476385736968938
UNH (0.7808251339267112, 8) (0.6704427034004119, 8) (0.6551801488855576, 8) (0.7390852278353224, 9) 0.5620503904931188
MRK (0.5458635448612557, 10) (0.09112990447475411, 9) (0.46179040107344754, 9) (0.17206740197627196, 9) 0.3690012852398665
PFE (0.6482962672774243, 1) (0.0645235864945026, 9) (0.18523311862999264, 9) (0.315496634828133, 9) 0.38749058745254766
ABBV (0.7488047929209422, 10) (0.623518646151443, 10) (0.46154321783211455, 12) (0.771831872434569, 12) 0.38799452370269444
ABT (0.8431346972203477, 9) (0.6369107970743543, 9) (0.38944784167661073, 9) (0.40526396686823674, 9) 0.441200751696362
TMO (0.9609336329820448, 1) (0.9736025540873782, 1) (0.8354591132611426, 1) (0.6539942701346969, 1) 0.4037147815602653
BMY (0.5708121325471311, 8) (0.10459407736004045, 9) (0.3737151446268847, 9) (0.48779877373237324, 9) 0.3192459990166295
AMGN (0.7305564050993771, 9) (0.5167672519475187, 9) (0.03294613413303493, 12) (0.09910015229408436, 12) 0.42594458265397095
LLY (0.7603669231246639, 9) (0.4554854133143188, 9) (0.5350992614414007, 9) (0.705743785255666, 9) 0.4447727046474098
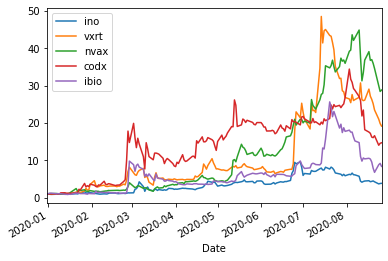
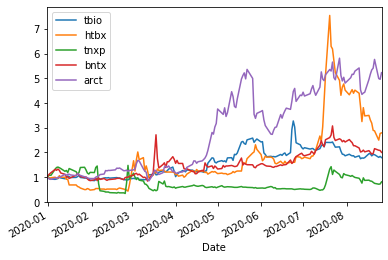
直近の状況
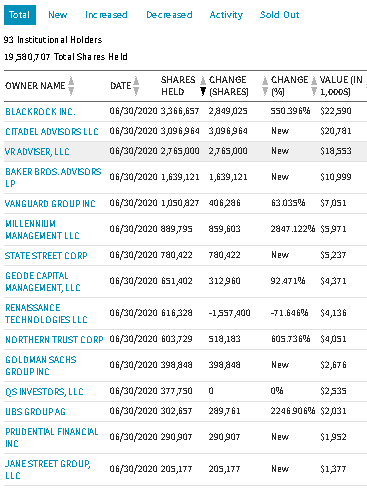
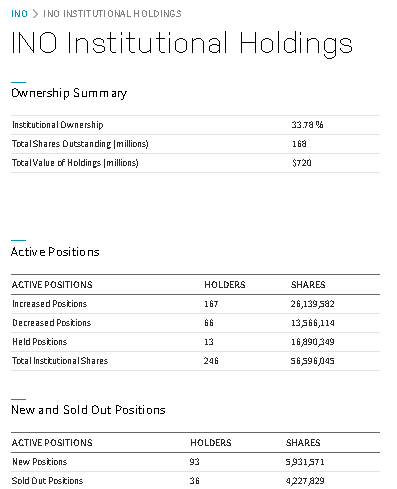
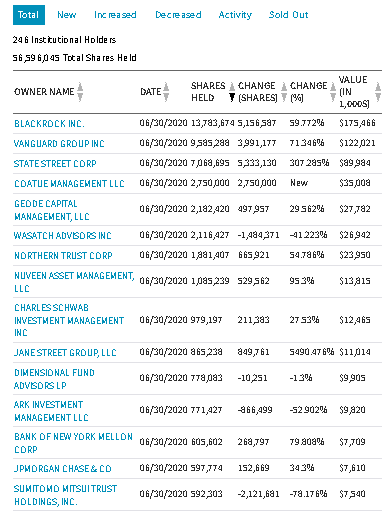
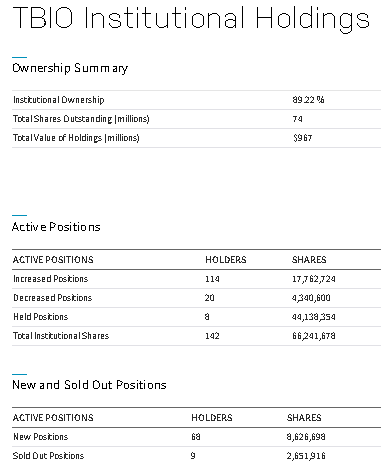
最近(2020/8/27)よく動く個別株
| コード | 銘柄 | セクター | フルタイム従業員数 | 時価総額$m |
|---|---|---|---|---|
| ino | Inovio Pharmaceuticals, Inc. | Biotechnology | 190 | 720 |
| vxrt | Vaxart, Inc. | Biotechnology | 14 | 131 |
| codx | Co-Diagnostics, Inc. | Diagnostics & Research | 22 | 89 |
| nvax | Novavax, Inc. | Biotechnology | 165 | 3,646 |
| ibio | iBio, Inc. | Biotechnology | 55 | 21 |
| tbio | Translate Bio, Inc. | Biotechnology | 93 | 967 |
| htbx | Heat Biologics, Inc. | Biotechnology | 35 | 14 |
| tnxp | Tonix Pharmaceuticals Holding Corp. | Biotechnology | 16 | - |
| bntx | BioNtech SE | Biotechnology | 1400 | 1,907 |
| arct | Arcturus Therapeutics Holdings Inc. | Biotechnology | 88 | 736 |
| vir | Vir Biotechnology, Inc. | Biotechnology | 237 | 2,303 |
| cydy | CytoDyn Inc. | Biotechnology | 10 | - |
| gene | Genetic Technologies Limited | Diagnostics & Research | - | - |
| mrna | mordena | Biotechnoloby | 975 | 15,313 |
UPDATE=["ino","vxrt","nvax","codx","ibio","tbio","htbx","tnxp","bntx","arct",
"vir","cydy","gene"]
ShorttermInvest(UPDATE,'2020/4/1')
ino (0.5204950364735113, 0) (0.3938358587956956, 1) (0.3647337261637889, 1) (0.5477459609108771, 1) 1.8866439596800761
vxrt (0.5204499298776905, 0) (0.628637798835109, 0) (0.2974637452308755, 4) (0.5997217869657101, 4) 2.244676608622388
nvax (0.3338858461767892, 13) (0.5800257558212606, 13) (0.3378282345158568, 13) (0.7783203812935748, 13) 1.7569830811569858
codx (0.5612641439716675, 1) (0.295489282045674, 0) (0.33384477305060095, 0) (0.18218993844955278, 0) 2.4258221883204425
ibio (0.2960818187348237, 3) (0.257835342290185, 3) (0.12755779163496023, 3) (0.3170121202718065, 3) 2.5637686321483772
tbio (0.6620483090737617, 2) (0.44347357016090305, 2) (0.4044514089363899, 2) (0.4304286287279991, 2) 1.0229077842906906
htbx (0.36465303728203424, 2) (0.34926358086970066, 2) (0.11715140821494069, 2) (0.25224255822564917, 2) 1.9965797305210615
tnxp (0.2204456208186812, 0) (0.03599867992717271, 0) (0.13226711416952802, 0) (0.02396613887675652, 0) 2.3869430625951362
bntx (0.6963130747874993, 2) (0.4906866455829821, 2) (0.09758371624365897, 2) (0.27290277706467925, 2) 1.4359495515988447
arct (0.8842082453805367, 11) (0.8562571671829029, 11) (0.17512678137195098, 11) (0.4469620640364873, 11) 1.2992418291456078
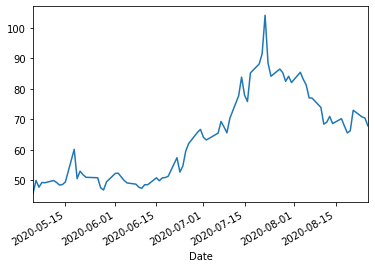
モデルナ https://www.modernatx.com/
web.DataReader("mrna","yahoo","2020/5/4").Close.plot()
2020年1月、Modernaは、Gilead Sciences、Vaxart、Inovio Pharmaceuticals、Novavaxなどの他のバイオテクノロジー企業と競合して、COVID-19コロナウイルスを阻害するワクチン(mRNA-1273)の開発を発表しました。 Modernaのテクノロジーは、mRNA-1273という名前のメッセンジャーRNA(mRNA)化合物であり、ウイルス上のスパイク(S)タンパク質の形態をコードするSARS-CoV-2に対する阻害を提供します。Modernaの株式は劇的に上昇し、CEOやその他の企業幹部は、彼らの持ち株の大規模なプログラム販売を開始しました。
2020年3月に、ワクチン候補のフェーズIヒト試験が米国国立アレルギー感染症研究所との提携で始まりました。 4月、米国生物医学先端研究開発局(BARDA)は、Modernaのワクチン開発に最大4億8,300万ドルを割り当てました。 5月に開始する第II相投薬および有効性試験の計画は、FDAにより承認されました。将来の製造に備えて、ワクチンが承認された場合、Modernaはスイスのワクチン生産者であるLonza Groupとパートナーシップを締結しました.
2020年5月、株式市場に直接向けた第1フェーズ前段階の予備的な報告で、45人の候補者の8人だけの部分的で非ピアレビューの結果を発表した。その後、CEOはCNBCに、12億ドルの資金調達を発表した。そのときの時価総額は300億ドルである。元FDAの委員であるスコットゴットリーブは、「モデルナの道のりは長い」と述べ、CNBCの聴衆を和らげた。ウォールストリートジャーナルは「モデルナの株の取り扱いに注意を払う」[45]と続き、スタットは、「ワクチン専門家は、モデルナはCovid-19ワクチンの評価に重要なデータを公表していないと述べている」と報告した。
5月25日、ModernaはフェーズIIaの臨床試験を開始し、参加者600人を募集して、候補ワクチンであるmRNA-1273の抗体反応の安全性と違いを評価した。この研究は2021年に完了する予定。7月7日、ロイターは、臨床試験のデータ共有や、政府の要求手順を実行する際の会社の不本意をめぐって、モデルナと政府の研究者との間に論争があることを報告した。 7月9日、モデルナは、Laboratorios Farmacéuticos Roviにワクチンが承認された場合に備えて、その製造契約を発表した。
7月14日、モデルナの科学者は、COVID-19ワクチン候補であるmRNA-1273の第I相臨床試験の予備結果を発表し、ワクチン接種から15日後の接種用量に応じた抗体産生と、発熱、注射部位の疲労、頭痛、筋肉痛、痛みなどの軽度から中程度の副作用を示しました。結果は、2020年の後半に米国で第III相試験に100マイクログラム用量のmRNA-1273の使用を許容できると見なされました。
参考:Moderna- Wikipedia
2020年7月28日-モデルナはCOVID- 19に対するワクチン候補であるmRNA-1273を評価する前臨床試験の結果を公表、ニューイングランド医学ジャーナルに掲載
-
mRNA-1273の2用量のワクチン接種は、ヒト以外の霊長類の上気道と下気道でのSARS-CoV-2感染に対する強力な免疫応答と防御につながり、ワクチン関連の呼吸器疾患の証拠がないことを示した( VAERD)。
-
免疫原性と防御効果を、4週間間隔で与え、mRNA-1273またはコントロールの10または100 µg用量の2用量ワクチン接種について評価した。2回目のワクチン接種の4週間後、動物に高用量のSARS-CoV-2を鼻腔内および気管内に与えた。2回のワクチン接種後、この非ヒト霊長類研究で観察された免疫反応は、同じくニューイングランドジャーナルオブメディシンで最近報告されたmRNA-1273のフェーズ1ヒト研究と一致した。
-
非ヒト霊長類(100 µg)の高用量では、中和抗体価がさらに上昇し、PsV GMTは1,862に達した。ワクチン接種はまた、主にTh1 CD4 T細胞であるT細胞応答の有意な増加をもたらした。mRNA-1273の10 µgと100 µgの用量レベルでSARS-CoV-2によるウイルス攻撃後の肺炎症から非ヒト霊長類を保護した。さらに、10 µgと100 µgの用量グループが肺でのウイルス複製に対する保護を示し、100 µgの用量は動物の鼻でのウイルス複製からも保護した。
2020年7月14日: モデルナは、ニューイングランドジャーナルオブメディスンでのCOVID-19(mRNA-1273)に対するmRNAワクチンの第1相試験の中間結果の発表
2020年7月14日-Moderna、Inc.は、ニューイングランドジャーナルオブメディシンで、COVID-19に対するワクチン候補であるmRNA-1273の非盲検第1相試験の中間分析の発表を発表した。この中間分析では、18〜55歳の45人の健康な成人参加者の3つの用量レベル(25、100、250 µg)で28日間隔で与えられたmRNA-1273の2用量ワクチン接種スケジュールを評価し、57日目までの結果を報告した。両方のワクチン接種を受け、事前に指定された時点で評価された初回用量コホートの参加者は、5月18日に発表されたポジティブな中間データ評価を再確認し、mRNA-1273がSARS-CoV-2に対して迅速かつ強力な免疫応答を誘導したことを示した。研究は国立衛生研究所(NIH)の一部である国立アレルギー感染症研究所(NIAID)が主導した。
mRNA-1273は一般的に安全で忍容性が高く、57日目までに深刻な有害事象は報告されていない。有害事象(AE)は一般に一時的で、重症度は軽度から中程度である。最も顕著な有害事象は250 µgの用量レベルで見られ、14人の参加者のうち3人(21%)が1つ以上の重篤なイベントを報告しました。要請された全身性の有害事象は、2回目のワクチン接種後により一般的であり、25 µgグループの13人中7人(54%)、100 µgグループの15人すべておよび250 µgグループの14人すべてに発生した。 100 µg用量での2回目のワクチン接種後に最も一般的に報告された全身性の有害事象は、疲労感(80%)、悪寒(80%)、頭痛(60%)および筋肉痛(53%)で、いずれも一過性で軽度または中程度だった。 100 µgの用量で最も一般的に引き起こされた局所的な有害事象は、注射部位の痛み(100%)であり、これは一過性であり、重症度は軽度または中程度であった。臨床安全研究所の評価がグレード2以上で、未承諾の有害事象の評価では、懸念のパターンは明らかになっていない。
mRNA-1273は、最初のワクチン接種後、すべての参加者の全長SARS-CoV-2スパイクタンパク質(S)に対する結合抗体を誘発し、15日までにすべての参加者がセロコンバージョンした。結合力価の用量依存的な増加が3つの用量レベルで見られた、および用量コホート内の初回ワクチン接種と追加ワクチン接種の間。 2回のワクチン接種後、57日目に、幾何平均力価は、COVID-19診断1が確認された38人から得られた回復期の血清で見られたものを超えた。回復期の血清グループの38人のうち、15%が重症の症状(入院に必要な入院)として分類されました集中治療および/または換気)、22%は中程度の症状があり、63%は軽度の症状があった。回復期の血清サンプルは、研究サンプルと同じアッセイを使用してテストされた。
中和活性は、2つの異なるアッセイ、ライブSARS-CoV-2プラーク減少中和テスト(PRNT)と偽ウイルス中和アッセイ(偽型レンチウイルスレポーター単一感染中和アッセイ、PsVNA)で評価された。参加者は、ワクチン接種前に検出可能なSARS-CoV-2ウイルス中和またはPsVNA応答を持っていなかった。
2回のワクチン接種後、mRNA-1273は強力な中和抗体力価を誘発した。 43日目に、評価されたすべての参加者でSARS-CoV-2(PRNT80)に対する中和活性が見られた。フェーズ3で選択された100 µgの用量では、相乗平均力価レベルは参照回復期血清で見られたレベルの4.1倍だった(n = 3)。
2回目のワクチン接種後、PsVNA中和抗体力価がすべての用量コホートのすべての参加者で検出された。100 µg用量での57日目の幾何平均力価は、回復期の血清で見られたものよりも2.1倍高かった(n = 38)。結合アッセイと中和アッセイの間、およびライブウイルスと偽ウイルス中和アッセイの間に強い相関関係が観察された。明確な用量反応は、25 µgと100 µgの用量レベルの幾何平均力価で見られ、250 µg用量での追加の増加は最小限だった。
T細胞反応も25 µgと100 µgの用量レベルで評価された。 2回目のワクチン接種後、mRNA-1273はTh2バイアスCD4 T細胞応答の有意な上昇なしにTh1バイアスCD4 T細胞応答を誘発した。
免疫応答の持続性の評価は現在進行中であり、参加者は2回目のワクチン接種後1年間追跡され、その期間を通じて定期的に採血が行われる。
この第1相試験の追加の7つのコホートが登録を完了した:成人18-55の50 µgコホート(n = 15)、高齢者の3つのコホート(n = 30、年齢56-70、25 µg、50 µg、 100 µg)と高齢者の3つのコホート(n = 30、71歳以上、25 µg、50 µg、100 µg)。これらのデータは個別に公開される予定。高齢者や高齢者におけるCOVID-19の罹患率と死亡率の増加を考えると、この集団を保護するワクチンの可能性に関する追加の証拠が緊急の優先事項だ。
mRNA-1273に関する企業の第2相試験では、18歳から55歳までの健康な成人(n = 300)と55歳以上の高齢者(n = 300)の両方のコホートが完全に登録された。この第2相プラセボ対照の用量確認研究では、mRNA-1273の2つのワクチン接種を28日間隔で行った場合の安全性、反応原性、および免疫原性を評価した。各参加者は、プラセボ、50μgまたは100μgの投与量を両方のワクチン接種で受けた。
フェーズ3研究プロトコルは、米国食品医薬品局(FDA)によってレビューされ、COVID-19ワクチン研究の臨床試験デザインに関する最近のFDAガイダンスと整合している。無作為化1:1プラセボ対照試験には、米国の100 µg用量レベルで約30,000人の参加者が含まれると予想される。主な最終目標は症候性COVID-19疾患の予防。主要な副次的評価項目には、重度のCOVID-19疾患の予防(入院の必要性によって定義される)およびSARS-CoV-2による感染の予防が含まれる。主な有効性分析は、症候性COVID-19疾患の参加者数に基づくイベント駆動型分析である。仮定を強化するためのCOVID-19に対するターゲットワクチンの有効性(VE)は60%である(下限が30%を超える場合の95%信頼区間)。この試験では、最終的なイベント駆動型分析の前に、約151のイベントで2つの中間分析(約53および106のイベント)が行われると予想される。このフェーズ3研究はCOVE研究と呼ばれる。 ClinicalTrials.gov識別子はNCT04470427である。
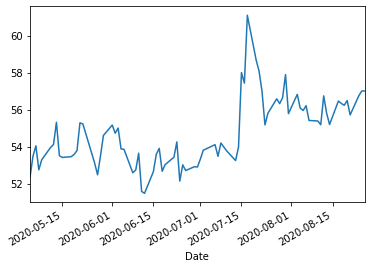
バクサート https://vaxart.com/
web.DataReader("vxrt","yahoo","2020/5/4").Close.plot()
バクサートによる主要なワクチンはインフルエンザ経口錠剤ワクチンであり、2015年の第I相臨床試験でインフルエンザウイルスに対する安全性と中和抗体反応を示している。2018年、バクサートはフェーズIIチャレンジ試験を完了しました。この試験では、バクサートインフルエンザタブレットワクチンは、注射用インフルエンザワクチンであるフルゾンによる27%の減少と比較して、プラセボと比較して39%の臨床疾患の減少を示した。
2020年1月、VaxartはCOVID-19を阻害する錠剤ワクチンの開発を発表しました。4月に、実験動物でCOVID-19のワクチン候補を用いた試験から陽性免疫応答を報告した。
2019年、複数のヘッジファンドがバクサートに投資した。最大の投資は、2520万株を取得したアーミスティスキャピタルである
2020年6月に、Vaxart COVID-19ワクチン候補が、Operation Warp Speedと呼ばれる米国COVID-19ワクチン開発プログラムに含まれた。
参考:Vaxart- Wikipedia
2020年8月10日- VaxartがCOVID-19ワクチンのIND申請を発表
2020年8月10日-Vaxart、Inc.は、COVID-19治験薬(IND)の申請が米国食品医薬品局(FDA)に提出されたことを発表した。
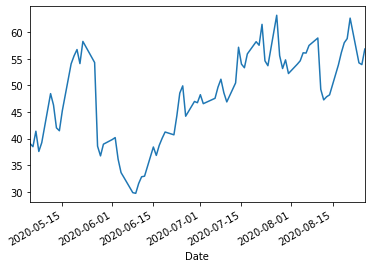
ノババックス https://novavax.com/
web.DataReader("nvax","yahoo","2020/5/4").Close.plot()
2018年、Novavaxは、Bill and Melinda Gates Foundationから予防接種用ワクチンの開発のために8,900万ドルの研究助成金を受け取った。
2020年5月、Novavaxは、同社のCOVID-19ワクチン候補(NVX-CoV2373)の健康な成人における初期段階の評価に資金を提供し、ワクチンが成功した場合には、大規模製造に備えてリソースを開発するために、 疫学準備イノベーション連合から3億8400万ドルを受け取りました。
CEPIはすでに3月に400万ドルを投資していました。
2020年1月、Novavaxは、SARS-CoV-2を阻害するためのNVX-CoV2373というワクチン候補の開発を発表した。 2020年3月、Novavaxは、ワクチン候補に関する前臨床および初期段階のヒト研究のためのEmergent BioSolutionsとの提携を発表しました。パートナーシップに基づき、Emergent BioSolutionsはボルチモアの施設でワクチンを製造する。 NVX-CoV2373という名前の候補者の最初の人間での安全性の研究は、オーストラリアで2020年5月に開始された。 7月、2021年までにコロナウイルスワクチン候補の開発を促進するため、オペレーションワープスピードから16億ドルを受け取った。Novavaxは、16億ドルが保健福祉省と国防総省の間の「協力」から生じたと発表した。
参考:Novavax- Wikipedia
2020年8月4日- COVID-19ワクチン候補の第1相データを発表
2020年8月4日- Novavax、Inc. 18〜59歳の健康な成人を対象に、Matrix‑M™アジュバントを併用する場合と併用しない場合のCOVID‑19ワクチンのプラセボ対照試験の結果を報告した。マトリックスMでアジュバント添加した同社の組換えCOVID-19ワクチン候補であるNVX‑CoV2373は、一般的に忍容性が高く、回復期のヒト血清よりも数値的に優れた堅牢な抗体反応を誘発した。データは、査読のために科学ジャーナルおよびmedRxiv.orgのオンラインプレプリントサーバーに提出。
NVX-CoV2373は忍容性が高く、安心できる安全プロファイルを備えている。全体として、ワクチンの忍容性は良好であり、反応原性事象は一般的に軽度だった。
用量1の投与に続き、圧痛と痛みが最も頻度の高い局所症状であり、全身事象は個々に頻度が低く、頭痛、疲労、筋肉痛が最も一般的に報告された。用量2の投与に続いて、より大きな反応原性が報告されたが、症状の大部分はグレード1以下として報告された。これらの症状の平均期間は2日未満。未承諾の有害事象は、用量2投与の28日後まで収集された。深刻な(グレード3)未承諾の有害事象はなく、有害事象の大部分は軽度であり、ワクチン接種とは無関係であると見なされた。重大な有害事象(SAE)は報告されていない。
NVX-CoV2373は、参加者の100%で中和力価を誘発した。 5 µgアジュバント投与群ピークGMT:3,906(95%CI:2,556; 5,970)。
すべての被験者がワクチンの単回投与後に抗スパイクIgG抗体を発現し、それらの多くは野生型ウイルス中和抗体反応も発症した。投与2後、参加者の100%が野生型ウイルス中和抗体反応を発症した。
抗スパイクIgG応答とウイルス中和応答の両方が、臨床的に重要なCOVID‑19疾患の患者からの応答に比べて有利だった。重要なことに、IgG抗体反応は中和力価と高度に相関しており、抗体のかなりの部分が機能した。
Matrix-M™アジュバントは、堅牢な多機能CD4 + T細胞応答を誘発した。アジュバントは用量節約であり、NVX‑CoV2373のより低い5 µg用量は25 µg用量と同等に機能した。
細胞性免疫応答は、NVX‑CoV2373は、Th1表現型(IFN-g、IL-2、およびTNF-a)への強いバイアスで抗原特異的な多機能CD4 + T細胞応答を誘発した。
NVX-CoV2373は安定しており、2〜8°Cで保存できる液体製剤での取り扱いが可能になるため、既存のインフラストラクチャでコールドチェーン管理ができる。
Novavaxはまた、カニクイザルにおけるNVX‑CoV2373予防接種の結果を査読付きジャーナルにデータを提出。
ワクチンは、上気道および下気道でのウイルス複製を妨げる無菌免疫を誘発し、COVID-19感染を減少させる可能性を示した。攻撃後の疾患の増強の証拠はない。これらのデータは、medRxiv.orgのオンラインプレプリントサーバーにも提出。
イノビオ https://www.inovio.com/
web.DataReader("ino","yahoo","2020/5/4").Close.plot()
2020年1月、疫病予防イノベーション連合(CEPI)は、SARS-CoV-2に対するワクチンの開発のために最大900万ドルをイノビオに供与すると発表した。イノビオは、CEPI、韓国国立衛生研究所、および国際ワクチン研究所とCOVID-19ワクチン候補を開発するためのパートナーシップを結んでいる。
イノビオは、中国のバイオテクノロジー企業である北京Advaccine Biotechnology Co. と協力して、中国の規制当局による承認を迅速化し、2020年の前半に中国でワクチン候補のヒト臨床試験を開始する計画をもつ。 予備的な有効性試験に成功した場合、ワクチン生産を拡大するために製造業者と提携している。 2020年4月、同社は米国でリードワクチン(INO-4800)のヒト第I相安全性試験、および韓国で第I-II相試験を開始し、COVID-19ウイルスに対する免疫化をテストした。
6月初旬に、イノビオは国際ワクチン研究所および韓国のソウル国立大学と提携し、ソウル大学病院で120人の参加者を対象に実施されるフェーズI-IIの安全性および有効性試験を進めました。 6月この研究は、疫病予防連合によって資金提供され、韓国疾病管理予防センターおよび韓国国立衛生研究所によってサポートされている。
参考:Inovio- Wikipedia
2020年6月30日-INOVIOは、COVID-19のINO-4800ワクチンのポジティブ暫定フェーズ1データを発表
2020年6月30日-INOVIOは、最初の2つの第1相臨床試験コホートから、新規コロナウイルス(SARS-CoV-2)に対するワクチン候補であるINO-4800の暫定臨床データを発表した。
INO-4800ワクチン接種は、SARS-CoV-2で攻撃されたマウスの肺におけるウイルス複製を無効にした。
INO-4800の第1相臨床試験では、参加者(18歳から50歳までの40人の健康な成人ボランティア)は、1.0 mgおよび2.0 mg用量コホートに登録され、各参加者は、4週間間隔で2回のINO-4800の投与を受けた。INO-4800は一般的に安全で、8週目までの両方のコホートのすべての参加者で忍容性が良好だ。報告された10件の有害事象(AE)はすべて、重症度がグレード1で、ほとんどが局所注射部位の発赤だった。重大な有害事象(SAE)は報告されていない。
体液性免疫応答および細胞性免疫応答を含む複数の免疫学アッセイが、6週目に2回の投与後に1.0 mgおよび2.0 mgの用量コホートの両方で実施された。今日までの分析では、体液性(結合および中和)およびT細胞免疫応答を評価する予備データに基づいて、94%(36名の試験参加者のうち34名)が全体的な免疫応答率を示した。
INO-4800は、暫定的な第1相データに加えて、SARS-CoV-2ウイルスチャレンジ研究でマウスを保護することが示された。この場合、INO-4800によるワクチン接種は、SARS-CoV-2に感染させた動物の肺でのウイルス複製を妨げた。
INOVIOのDNAワクチンの重要な特徴の1つは、バランスの取れた抗体とT細胞免疫応答を生成する能力だ。INO-4800は、室温で1年以上安定で唯一の核酸ベースのワクチンであり、重要な要素である輸送中または保存中の数年間冷凍する必要なし。
2020年8月10日-INOVIO2020年第2四半期の財務結果+DNA医薬品臨床プログラム中間年更新
この試験では、米国の2つのサイトで18歳から50歳までの40人の健康な成人ボランティアを登録した。参加者は、1.0 mgおよび2.0 mg用量コホートに登録された。各参加者は、INOVIOのCELLECTRA®2000デバイスを使用して皮内注射により投与され、4週間間隔のINO-4800の2回の投与を受けた。INOVIOは、完全な臨床データを査読付き医学雑誌に提出。
INO-4800は一般的に安全で、8週目までの両方のコホートのすべての参加者で忍容性が良好だった。深刻な有害事象(SAE)は報告されておらず、6件は軽度(すべてグレード1の重症度)のワクチン投与に関連する一時的な有害事象が報告された。試験参加者の100%(38人中38人)は、結合および中和抗体反応とT細胞免疫反応に基づいて全体的な免疫学的反応を示した。
ワクチン接種を受けた参加者の95%は、2回のワクチン接種後に全体的な血清変換(中和および/または結合抗体で応答する参加者として定義された)をした。
ワクチン接種された参加者のほぼ90%が、CD8 +キラーT細胞応答を含む強力なT細胞応答を生成した。
T細胞の応答は、テストされた回復期のサンプルよりも大きさが高く、以前に他のワクチン候補について報告されたものと同様またはそれ以上の応答だった。フェーズ1試験も最近拡張され、18歳以上の参加者が80名増え、年齢の上限はなく、低用量群が含まれる。
ビオンテック https://biontech.de/
web.DataReader("bntx","yahoo","2020/5/4").Close.plot()
- IPO
2019年1月、BioNTechは、ドイツの株式会社( "AG")からヨーロッパの株式会社( "Societas Europaea"または "SE")への法人形態の変更しました。2019年8月までに、BioNTechは株式の私募およびコラボレーションを通じて13億ドルの資本を調達しました。 BioNTechの株主には、StrüngmannFamily Office(大多数の株主)、Fidelity Management&Research Company、Invus Group、LLC、Janus Henderson Investors、MIG Fonds、Redmile Group、Salvia GmbH、およびヨーロッパのいくつかのファミリーオフィスが含まれる。 ]
2019年9月、BioNTechは、Bill&Melinda Gates Foundation(BMGF)と、HIVおよび結核プログラムを開発するための契約を結びました。目的は、HIVおよび結核感染の予防と、長期にわたる抗レトロウイルス療法なしのHIV疾患の寛解のための前臨床ワクチンと免疫療法の候補を特定して開発することだ。
BioNTechは、2019年10月10日に米国の技術交流Nasdaqに上場されました。
- Covid19 ワクチン
2020年4月22日、BioNTech SEとPfizerについて、ドイツの規制Paul-Ehrlich-Institut当局は、COVID-19感染を防止するためのBioNTechのBNT162ワクチンプログラムのフェーズ1/2臨床試験を承認した。BioNTechとファイザーは共同でBNT162を開発している。この試験は、COVID-19ワクチン候補のドイツでの最初の臨床試験であり、世界的な開発プログラムの一部である。4つのワクチン候補は、BioNTechのCOVID-19に焦点を合わせたプロジェクト「Lightspeed」からの最初の候補であり、それぞれが異なるmRNA形式と標的抗原を表している。4つのワクチン候補のうち2つはヌクレオシド修飾mRNA(modRNA)を含み、1つはウリジン含有mRNA(uRNA)を含み、4つ目のワクチン候補は自己増幅mRNA(saRNA)を利用している。各mRNAフォーマットは、脂質ナノ粒子(LNP)製剤と組み合わされている。大きいスパイクシーケンスは2つのワクチン候補に含まれており、スパイクタンパク質からの小さい最適化された受容体結合ドメイン(RBD)は他の2つの候補に含まれている。RBDベースの候補には、ウイルスを不活化できる抗体を引き出すために最も重要であると考えられているスパイクの一部が含まれている。
- 2020/2/22
今年行われる可能性の有る米国食品医薬品局によって緊急使用許可が与えられた場合、トランプ政権は、ファイザー(PFE)とBioNTech(BNTX)との連合に約20億ドルを提供し、1億回分のワクチンを製造すると発表した。
アストラゼネカとオックスフォード大学 https://www.astrazeneca.com/
web.DataReader("azn","yahoo","2020/5/4").Close.plot()
4月、同社がGlaxoSmithKlineおよびケンブリッジ大学と協力して、1日あたり30,000のCovid-19テストを実行できる新しいラボを開発していると報告した。Covid-19の治療におけるカルクエンスの潜在的使用を評価する臨床試験の計画を発表した。
2020年6月、国立アレルギー感染症研究所(NIAID)は、オックスフォード大学とアストラゼネカによって開発された潜在的なワクチンのテストの第3フェーズが2020年7月に始まることを確認した。
2020年6月、さらに1億回分の投与量を英国のNHSで利用できるようにする.アストラゼネカとEmergent BioSolutionsは、特に米国市場向けにオックスフォード大学のアデノウイルスベースのCOVID-19ワクチンを製造するために8,700万ドルの契約を結んだ。この契約はトランプ政権のオペレーションワープスピードイニシアチブの一部である。
2020年6月13日、アストラゼネカは、フランス、ドイツ、イタリア、オランダで形成されたグループであるヨーロッパの包括的ワクチン同盟と、実験用COVID-19ワクチンの最大4億回分をすべてのEU加盟国に供給する契約を結んだ。
2020年7月、アストラゼネカはIQVIAと提携し、オックスフォード大学で開発されたCOVID-19ワクチンAZD1222の米国での臨床試験を迅速化した。
2020年7月20日 . COVID-19ワクチンAZD1222は、第I/II相臨床試験の全参加者で強固な免疫反応を示した.
中間データは、強い抗体反応とT細胞反応を示した
オックスフォード大学主導のCOV001試験(第I/II相試験)の中間結果は、AZD1222の忍容性とSARS-CoV-2ウイルスに対する頑健な免疫反応を評価対象者全員に認めた。
COV001試験は、18~55歳の健康な成人1,077名を対象とした、盲検、多施設、無作為化比較第I/II相試験だ。この試験では、AZD1222の単回投与量を、比較対象となる髄膜炎球菌複合ワクチンであるMenACWYと比較して評価した。また、10名の参加者には、1ヶ月間隔でAZD1222を2回投与した。
Lancet誌に発表された結果では、AZD1222の単回投与により、注射後1カ月後の参加者の95%でSARS-CoV-2ウイルススパイクタンパクに対する抗体が4倍に増加した。すべての参加者において、T細胞反応が誘導され、14日目までにピークを迎え、注射後2ヵ月後も維持された。
SARS-CoV-2に対する中和活性(MNA80アッセイによる評価)は、ワクチン接種後1ヵ月後の参加者の91%、および2回目の接種を受けた参加者の100%で認められた。1回または2回目の接種を受けた参加者の中和抗体のレベルは、回復期のCOVID-19患者の中和抗体のレベルと同程度であった。中和試験では強い相関が観察された。
初期の安全性反応では、一過性の局所反応および全身反応がAZD1222群で一般的であり、過去の試験や他のアデノウイルスベクターワクチンと同程度であることが確認された。AZD1222では重篤な有害事象は報告されていない。鎮痛剤であるパラセタモールを予防的に使用することで反応は軽減され、2回目の投与後の発現頻度も低くなった。
現在、英国、ブラジル、南アフリカで後期第2/3相試験が実施されており、米国でも開始される予定。この試験では、このワクチンがCOVID-19からどの程度の防御効果があるかを判断し、異なる年齢層や投与量で安全性や免疫反応を測定する。
COVID-19病に対する防御の免疫相関
COVID-19に対するワクチンの保護の相関関係はまだ定義されていない。SARS-CoV-2感染から回復した患者では、高レベルの中和抗体が実証されている。さらに、新たなデータは、T細胞反応が病気の緩和に重要な役割を果たす可能性を示唆している。ウイルスに感染したが無症状のままであった人の中には、検出可能な抗体を持たない頑健な T 細胞応答を示した人もいる。SARS-CoV-2ウイルスに対する抗体およびT細胞の迅速な誘導は、COVID-19に対する防御において重要である可能性がある。
Sekine, T., et al., Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. BioRxiv, 2020. preprint doi: https://doi.org/10.1101/2020.06.29.174888.
アークトゥルス(Arcturus Therapeutics) https://arcturusrx.com/
web.DataReader("arct","yahoo","2020/5/4").Close.plot()
アークトゥルスセラピューティクスは、RNAに焦点を当てた希少疾患の治療法の発見、開発、商品化に焦点を当てたアメリカのバイオテクノロジー企業だ。 LUNAR®と呼ばれる、強力で安全な新しいRNA治療プラットフォームを開発している。LUNAR®は、小干渉RNA、メッセンジャーRNA、遺伝子編集、DNA、アンチセンス、マイクロRNAオリゴセラピューティクスなどのRNA医薬品向けの独自の脂質対応デリバリーシステムである。 同社のパイプラインには、オルニチントランスカルバミラーゼ欠損症(OTCD)などの希少疾患や、嚢胞性線維症などの呼吸器疾患に対するRNA治療法が含まれる。 ワクチン医薬品にはCOVID-19のワクチン候補が含まれ、COVID-19の大流行に対応して、デュークNUSメディカルスクールと提携し、STARRTMテクノロジーを使用してCOVID-19ワクチンを開発している。ヒトでのLUNAR-COV19臨床試験は2020年7月に始まった。
2020年8月11日:アークトゥルスファーマシューティカルは、フェーズ1/2試験でCOVID-19 STARR™mRNAワクチン候補、LUNAR-COV19(ARCT-021)の投与の開始を発表した。
2020年8月11日-Arcturus TherapeuticsはCOVID-19のARCT-021治験ワクチンを用いた第1/2相臨床試験を実施したことがを発表した。この研究は、グローバルなCROであるCTI臨床試験およびコンサルティングサービスと、シンガポールのデュークNUSメディカルスクールと共同で実施されている。
ARCT-021フェーズ1/2試験は2つの部分で構成される。段階1では、21〜55歳の若い成人に単回注射として段階的用量が投与される。このグループの安全性、免疫原性、T細胞反応のデータに基づいて、フェーズ2でさらに評価する用量レジメンを選択する。これには、若年成人および56〜80歳の高齢者のコホートが含まれる。この研究は、NCT04480957で登録されている。
ARCT-021の前臨床データは、非常に低い2 µgの用量を使用した単回投与後の中和抗体の100%の血清変換で非常に有望な結果を示した。中和抗体は投与後60日間増加し続けた。前臨床結果はまた、堅牢なCD8 + T細胞誘導およびTh1バイアスTヘルパー細胞免疫応答を示した。 ARCT-021ワクチン候補はウイルスがなく、ウイルスベクターまたはアジュバントを利用していない。 ARCT-021は、Arcturusの自己転写および複製(STARR™)mRNAテクノロジーを利用しアークトゥルス独自のLUNAR®脂質媒介送達システムで送達される。
集団訴訟
vxrt
Contact Information
Matthew E. Guarnero
Bernstein Liebhard LLP
https://www.bernlieb.com
(877) 779-1414
codx
CONTACT JAKUBOWITZ ABOUT CODX:
https://claimyourloss.com/securities/co-diagnostics-inc-loss-submission-form/?id=8465&from=1
Class Period : February 25, 2020 - May 15, 2020
Lead Plaintiff Deadline : August 17, 2020
Inovio
KESSLER TOPAZ MELTZER&CHECK、LLP:INOVIO PHARMACEUTICALS、INCに対して証券の不正行為を訴えた投資家集団訴訟
https://www.ktmc.com/new-cases/inovio-pharmaceuticals-inc-ino-1?utm_source=PR&utm_medium=link&utm_campaign=inovio
Moderna
株主アラート:ポメランズ法律事務所、Moderna、Inc.-MRNAの投資家に代わって請求を調査
https://www.globenewswire.com/news-release/2020/07/03/2057589/0/en/SHAREHOLDER-ALERT-Pomerantz-Law-Firm-Investigates-Claims-On-Behalf-of-Investors-of-Moderna-Inc-MRNA.html
Novavax
かなりたくさんの法律事務所が調査を開始している。
2021/10/19 https://www.bgandg.com/nvax
2021/10/26 https://www.blockleviton.com/cases/nvax
SECによるコロナウイルス関連の投資詐欺に関する投資家向けアラート(Look Out for Coronavirus-Related Investment Scams - Investor Alert Feb. 4, 2020 Updated June 23, 2020)
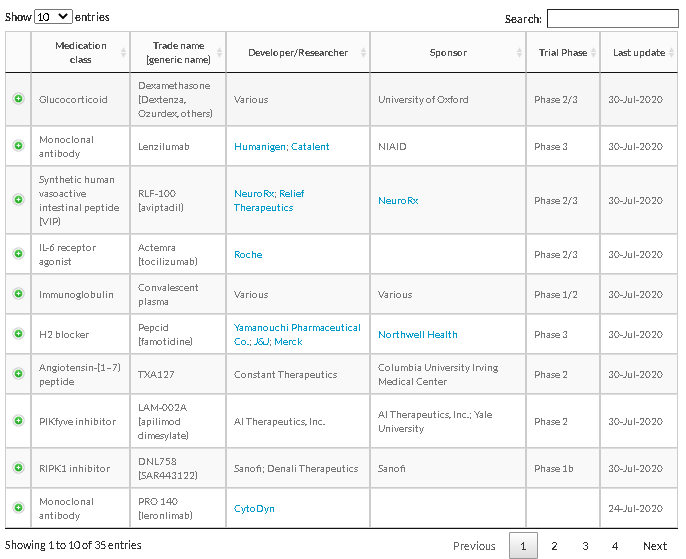
治験の状況(2020/7/16)
WHO Draft landscape of COVID-19 candidate vaccines 13 August 2020 | Publication
https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
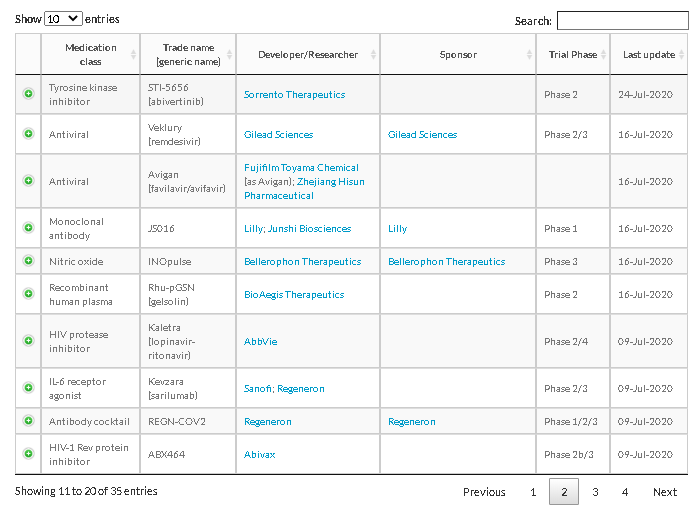
ワクチンの治験
出所:https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker
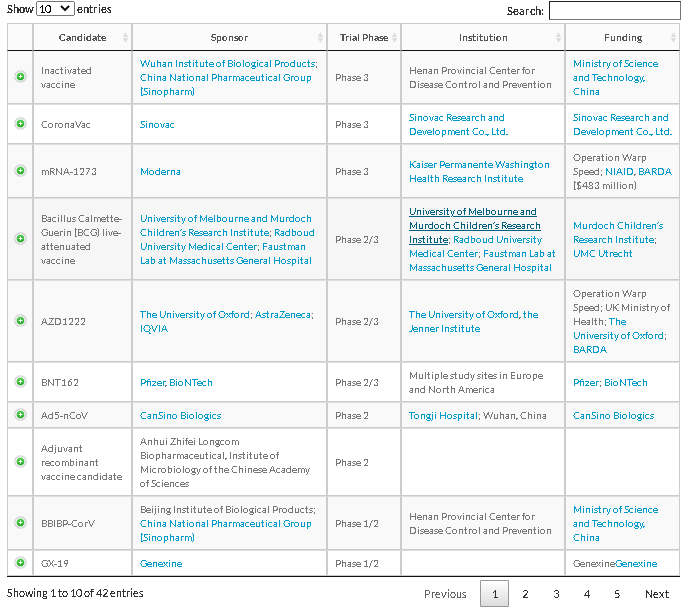
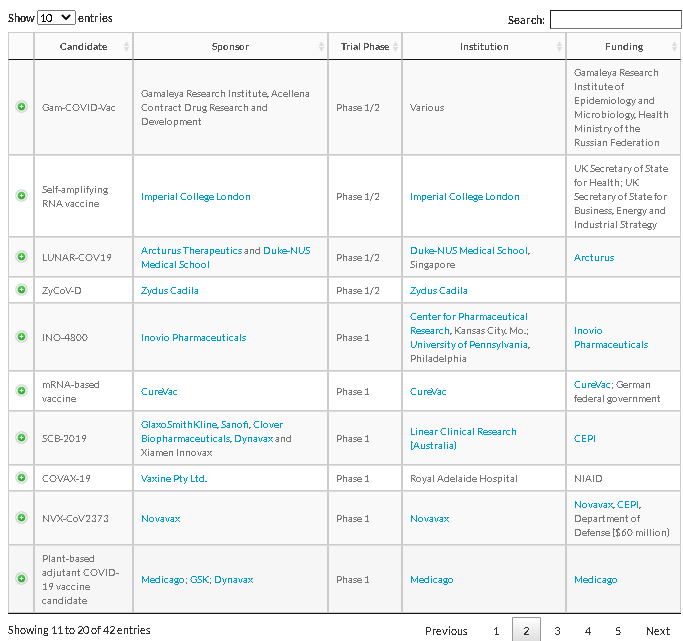
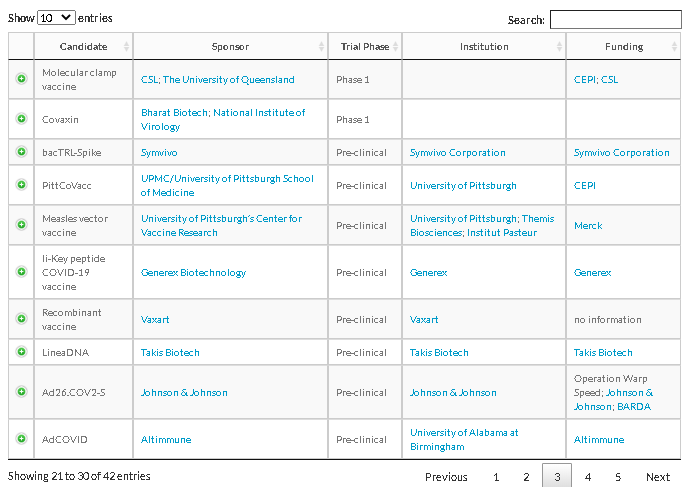
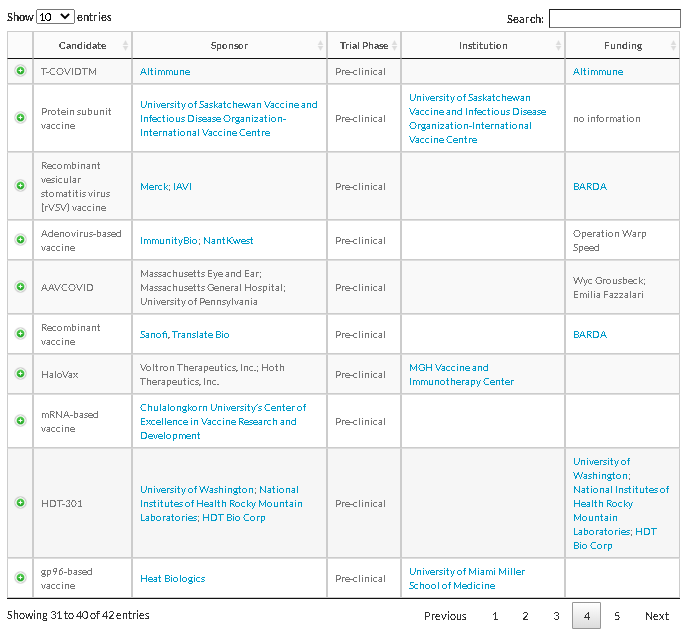
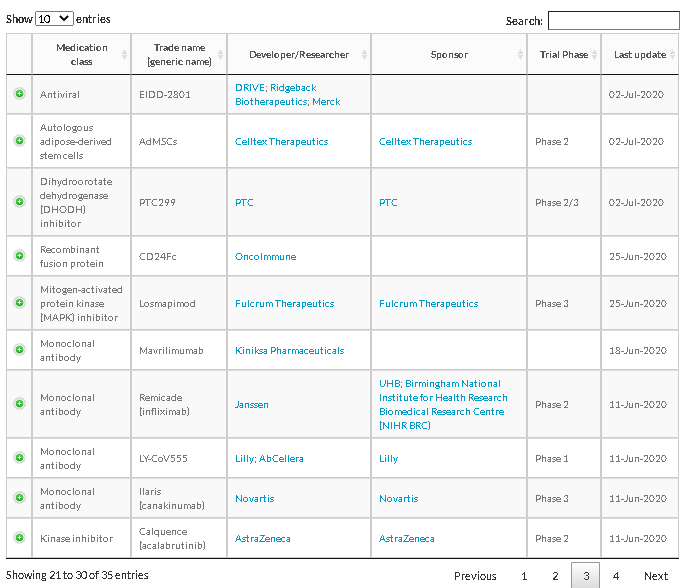
治療薬の治験
出所:https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-therapeutics-tracker
第2波の察知(2020/7/17)
その他まとめ
| コード | 配当 | 出資・援助 | 活動拠点 | その他 |
|---|---|---|---|---|
| AMGN | 2.85% | 米国 | ||
| AZN | 2.53% | 英国 | ||
| GILD | 3.68% | 米国 | EUA | |
| GSK | 4.60% | BARDA | 米国 | |
| JNJ | 2.75% | BARDA | 米国 | 治験、複製ウイルス運び屋型 |
| MRK | 3.19% | 米国 | イベルメクチン治療薬 | |
| PFE | 4.08% | 米国 | ||
| RHHBY | 2.56% | BARDA | スイス | |
| SNY | 3.58% | BARDA | フランス | 治験、抗厚性補助遺伝子組み換え型 |
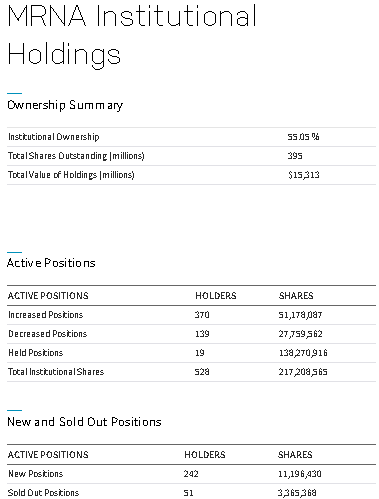
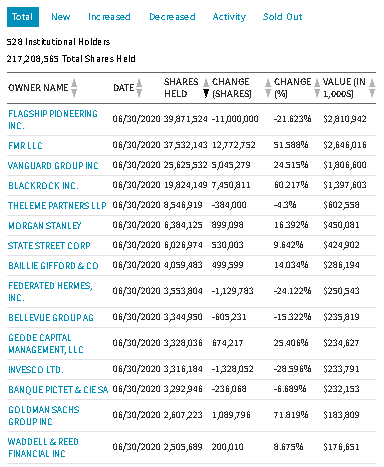
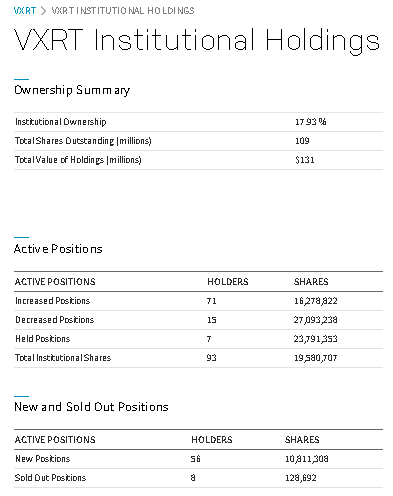
https://www.nasdaq.com/market-activity/stocks/mrna/institutional-holdings
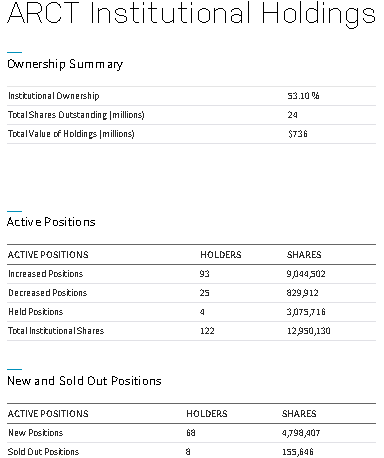
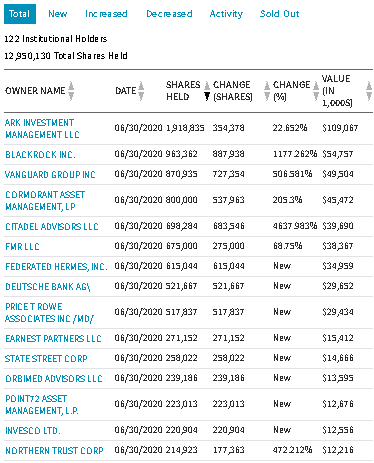
https://www.nasdaq.com/market-activity/stocks/arct/institutional-holdings
注目すべき動き
Operation Warp Speed
COVID-19 vaccine
Progress Published: 29 July 2020 T cell responses in patients with COVID-19
SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls
Emergent BioSolutions
[Emergent BioSolutions | Global Specialty Life Sciences ...]https://www.emergentbiosolutions.com/)
参考
Python3ではじめるシステムトレード【第2版】環境構築と売買戦略

「画像をクリックしていただくとpanrollingのホームページから書籍を購入していただけます。
「シュワッガーのテクニカル分析」
<IMG SRC="http://www.tradersshop.com/images/prod/9784775970270.jpg"BORDER=1 WIDTH=70 HEIGHT=100