1.燃焼の基礎
1.1.燃焼
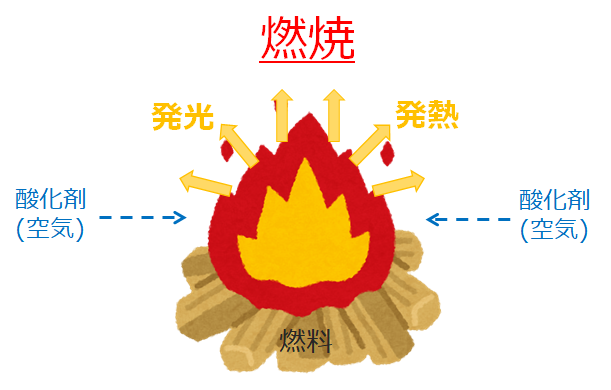
燃焼は、以下2つの条件が満たされる、発熱と発光を伴う急激な酸化反応である。
- 発熱を伴うこと。
- 火炎が発生すること。
金属が錆びることも酸化反応であり、多少の発熱を伴う場合もあるが(カイロなど)この場合は火炎を生じないため、燃焼とは呼ばない。
また、以下の3条件が満たされなければ燃焼は起こらない。
- 燃料
- 酸化剤
- 着火源
1.2.火炎
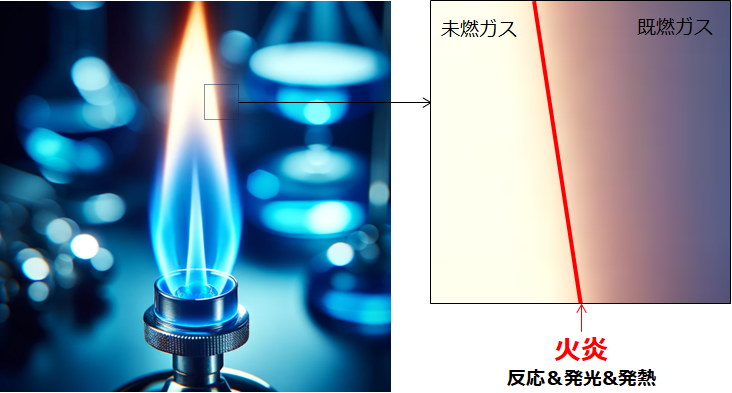
バーナー火炎の図を示す。未燃ガスと既燃ガスの境界部で、活発な酸化反応&発熱&発光が確認される部分を『火炎』と呼ぶ。発熱や発光があっても、酸化反応が起こっていない場合は火炎とは呼ばない。
1.3.燃焼における酸化剤
酸化剤は気体・固体・液体のものが存在する。最も関わりのあるものは酸素を含む空気であるが、その他の酸化剤の種類を示す。
| 相分類 | 酸化剤 例 |
|---|---|
| 気体 | 酸素、フッ素、塩素、空気 |
| 液体 | 液体酸素、硝酸 |
| 固体 | 硝酸カリウム、塩化カリウム |
また、同じ燃焼反応において用いる酸化剤により燃焼温度が異なる。例えば、酸化剤として空気を用いた場合と純粋な酸素を用いた場合では、純粋な酸素を用いた方が燃焼温度が高い。これは、空気に含まれる窒素が燃焼反応に関与せず、燃焼時に昇温する際、窒素は熱が奪って燃焼ガスと同じ温度になろうとすることで、燃焼温度が低下するためである。
燃焼時に発生する熱エネルギーはは、燃料の単位質量あたりの熱量としてされされ、発熱量と呼ばれる。この発熱量は、酸化剤と燃料の割合によって変化する。
1.4.燃焼温度
水素の燃焼反応を例に、燃焼温度を考える。水素と酸素の燃焼反応式は以下となる。
- $2H_{2}$+$O_{2}$ = $2H_{2}O$
2molの水素と1molの水素が供給された場合には、完全燃焼となり、すべてのガスが反応し、生成物は水のみとなる。
一方、水素過多の場合と酸素方の場合の反応式をそれぞれ示す。
- $3H_{2}$+$O_{2}$ = $2H_{2}O$+$H_{2}$
- $2H_{2}$+$2O_{2}$ = $2H_{2}O$+$O_{2}$
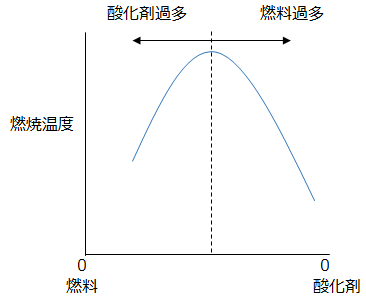
この場合、未反応のガスが残存する形となる。前項で説明した通り、反応に関与しない物質が存在する場合、反応時に熱を奪って昇温することから、上記のいづれの場合も、完全燃焼と比較して燃焼温度が低下することとなる。燃料/酸素の比率に対する燃焼温度について模式図を以下に示す。
1.5.空燃比・当量比
前項では、水素と酸素の比率によって燃焼温度が変わることを説明した。気体の燃焼を考える場合は、酸化剤として空気を対象とすることが多く、その際の空気と燃料の質量割合を空燃比と呼ぶ。
AF = \frac{空気の質量}{燃料の質量}
燃料が完全燃焼できるための最小の空気量を理論空気量といい、その時の空燃比を理論混合比と呼ぶ。
また、理論混合比を基準として当量比φを定義する。
φ = \frac{理論混合比}{実際の混合比}
\begin{equation}
φ= \left \{
\begin{array}{l}
1 理論混合比 \\
< 1 燃料希薄 \\
> 1 燃料過多 \\
\end{array}
\right.
\end{equation}
当量比=1となる理論混合比で混合された場合が、もっとも燃焼温度が高くなる。そこから燃料希薄・燃料過多に転じると燃焼温度は低下する。
1.6.断熱燃焼温度
燃焼する際に、熱損失がない(外部に熱が出ていかない)ときの燃焼ガスの最終温度を断熱燃焼温度と呼ぶ。特に、理論混合比で完全燃焼する反応を考える場合を理論断熱燃焼温度(理論断熱火炎温度)と呼ぶ。
実際には、完全燃焼は起こらず熱解離を伴う化学平衡状態で反応は停止する。この時の最終温度を平衡断熱燃焼温度と呼ぶ。
熱解離とは、高温状態において分子の運動が激しくなると、分子間の衝突によって原子分子が分解し安定する現象である。(H2Oは熱解離によってH2,O2,OHなどの2原子分子になって安定する)熱解離が起こる場合は、エネルギーを吸収して安定化するために理論断熱燃焼温度よりも低下することとなる。平衡断熱燃焼温度は、燃焼時の素反応を含む化学平衡計算を行うことで求められる。