はじめに
どうも(^^)/ 物理学科2年の たねほかほか です。
所属は生物物理班です!
生物物理?生物なのかい?物理なのかい?どっちなんだい!?ブーツリ、パワー!と思われたそこのあなた、我らが班長が紹介記事を書いているのでさあ読みましょう。
実は生物物理班は休止していたところをこの秋に現班長が復活させたばかり。最も新しく、今理物で一番勢いのある我々生物物理班がこのクリスマスイブという大切な日の記事を担当するのは、これ当然なんですね。$\tiny{スミマセン本当は今日しか空いてなかったのでビビりながら書いてます...}$
さて、本題。皆さんは今年の6月に京都でIUPAB2024という超大規模な生物物理の国際学会が開催されていたことをご存じでしょうか?今回は私が学科選択に悩んでいた時に参加し、結果的に物理学科進学の決め手となった大会の、その中でも特に私が感動した発表をいくつかご紹介します。中学以来馴染みのある生物の仕組みが、いかに合理的で美しいものだったのか、私が会場で感じた興奮を皆さんにお伝えできれば幸いです。
IUPAB2024
IUPABとはInternational Union of Pure and Applied Physicsの略で、1961年に設立された生物物理の国際学会です。
IUPABでは3年に一度 Congress と呼ばれる大会を開催しており、今年はその21回目の大会、IUPAB2024が京都国際会館での6月24日-28日の5日間にわたって行われました。前々回はイギリスのエジンバラ、 前回はブラジルのフォス・ド・イグアス(コロナで1年延期+オンライン開催に変更)と世界中を巡っていて、今回の京都大会は1978年奈良で行われた第3回大会以来、実に46年ぶりとなる二回目の日本開催でした。
「Lipid and Membrane Biophysics」や「DNA/Chromatin Physics」、「Structure, Function and Biophysics of the Bacterial Motility and Flagellar Motor」(細菌の移動、鞭毛モーターの物理)なんていうセッションまであり、生物物理の裾野の広さには会期中何度も驚かされました。またスピーカーも豪華で特別講演では我らが金子邦彦先生や、今年の秋ノーベル化学賞を受賞されたタンパク質構造解析のDavid Baker博士も(こちらはZoomでしたが)お話されました。
研究紹介
生体膜と相転移
Biological tuning of the membrane phase transition facilitates plasma membrane organization and function. Sarah Veatch (University of Michigan)
生物の世界では今、相分離という言葉が非常に流行っています。『相分離生物学』 という題名の本が出版されているくらいです。普通相分離と言うと細胞質中のタンパク質や核酸がそれぞれいくつかの相を作り、局所的に反応の場を作る細胞内相分離のことを指しますが、今回は題の通り生体膜(細胞膜や細胞小器官の膜)の相分離についての発表でした。
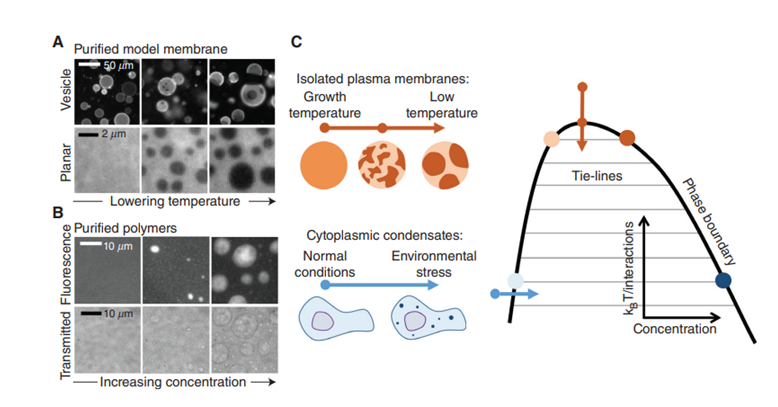
これまでの研究からは、生体膜はそれぞれの生物の置かれている環境(温度や組成)では一つの相からなっていること、一方で、一般の相分離現象と同じく温度を下げることによって二相に分離されることが知られていました(下図A,C)。一つ、細胞膜の相分離が細胞質中のそれと大きく異なるのは、構成要素の脂質がタンパク質や核酸と比べて比較的小さく、二次構造をとることができないため、相互作用を差別化することが難しく、たとえ相分離したとしても、たかだか二相にしか分離しないということです。(それぞれ飽和脂肪酸が多く含まれるLiquid-order($L_o$)相と、不飽和脂肪酸に富むLiquid-disorder($L_d$相と呼ばれます。)そのため、細胞内の相分離と比べ、特異的に特定の物質を凝集させるような機能では大きく劣ります。しかし、生物は細胞膜の相分離を巧みに利用しているのです。その鍵はその組成の絶妙な調整にあります。(個人的に一番驚いたのはここ)
発表では脂質膜は、細胞内の脂質循環によってその組成が相分離の臨界点付近に常に保たれているという描像が提示されました(!)(下図C右の相図オレンジ)。μmスケールで見ると一相に見える脂質膜も、実は組成が臨界点に近いがために、nmスケールでは外力の「むら」や組成の変化によって局所的に相分離が起きているというのです。一般にこのような刺激応答性を「compositional susceptibility」と呼びます。生物は膜の組成を臨界点付近に保つことによって、非常に高い「compositional susceptibility」を実現し、細胞内外の刺激を受けて、局所的に相分離、周囲の膜タンパク質の活性や局所的な組成を変化させることによってそれに応答していると考えられているそうです。また、近年では温度が変わると、当然臨界点の組成も変わるのですが、それに対応して同種の生物を異なる温度で生育すると細胞は脂質膜の組成を自発的に変えたという実験結果も報告されています。(Burns et al. 2017)
生体ゆらぎによる分子モーターの加速
Nonequilibrium ebergetics and noise-induced accelerayion of molecular motor, kinesine-1. Takayuki Ariga (Osaka University)
我々の細胞の中では、この動画のようにモータータンパク質と呼ばれる微小管の上を歩くタンパク質によって物質の輸送が行われています。(かわいいですね。)しかし、実はこの動画には一つ現実とは大きく異なる点があります。それはゆらぎによる撹乱が全く無視されている点です。細胞内には大きく二種類のゆらぎがあります。一つは生物に限らず存在する熱ゆらぎですが、もう一つ細胞では細胞骨格が収縮、伸張する力学的な作用によって発生する生物特有のゆらぎがあります。本研究(Ariga et al. 2021)ではモータータンパク質の一種であるキネシンの速度がゆらぎをうけることによってどのように変化するのかを検証しました。(実験&シミュレーション)
実験ではキネシンにビーズを運ばせ、そのビーズに光ピンセットで生体内のゆらぎを模したノイズを加えてキネシンの歩く速度がどのように変化するかを計測しました。その結果、なんとノイズの大きさ(標準偏差)が大きくなればなるほど、キネシンの歩く速度が上昇したのです(!)。実験でかけることのできるノイズの大きさには限りがあり、生体内と同等の大きさのノイズを加えることはできなかったものの、発表者の立てたモデルのシミュレーションでは生体内に近い大きさのノイズを加えると、運んでいる荷重の大きさに関係なく、水中を何も持たずに歩く時と同じ速度が達成できるという結果を得ています。
一般にある活性化エネルギーを持つ反応がどれくらいの速度で進むのかというのはアレニウスの式で書かれますが、外力がある場合は、それによってポテンシャルが変化し、速度定数$k$が$F$を外力、$d$を系に特有の長さのスケールとして$$k\propto\exp(Fd/k_BT)$$という外力依存性(アレニウス型依存性)が生じます。発表者の論文(Ariga et al. 2021)ではこの式が$F$について下に凸であることから、イェンセンの不等式(下に凸な関数では平均の像より像の平均の方が大きい)という簡単な不等式によってキネシンの加速を説明していました。このアレニウス型依存性はキネシンに限った話ではなく、広く酵素全般がより細胞内のような高ノイズ環境で最もよいパフォーマンスを発揮する可能性が示唆されています。
分子ローターによる対ファージ免疫
5:2 molecular motors - from bacterial motility to anti-phage defense. Nicholas M. I. Taylor (University of Copenhagen)
細菌は鞭毛は、細胞の内と外のプロトン勾配を利用して分子ローターを細胞膜上で回転させることで動きます。実は近年、この分子ローターが移動だけでなく、バクテリオファージ(細菌に感染するウイルス)から細菌の身を守る免疫システムの重要な役割を持っていることが明らかになりました。
スミマセン!続きは後日書きます!
参考文献
・Sarah A. Shelby, Sarah L. Veatch. 2023. https://cshperspectives.cshlp.org/content/15/11/a041395
・Margaret Burns et al. 2017.
https://linkinghub.elsevier.com/retrieve/pii/S0006-3495(17)30505-2
・Takayuki Ariga et al. 2021.
https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.127.178101
・有賀隆行 他. 2023.
https://www.jstage.jst.go.jp/article/biophys/63/2/63_86/_pdf/-char/en
・Haidai Hu et al. 2024.
https://www.nature.com/articles/s41586-024-08493-8